
سليم سعيد تويــج / جامعة الكـــوفة / كلية الزراعة
محـي مـزهر علــــوان / مديـــريــــة زراعــــة بـــابـــل
تضمنت هذه الدراسة امكانية انتاج مبيد حيوي من لقاح الفطر Beauveria bassiana (Balsamo) Vuillemin المعزول من يرقات حفار ساق النخيل ذو القرون الطويلة بتحميله على مواد حاملة سهلة وانتاجه على نطاق تجاري واسع وبشكل اقتصادي يسهل تداوله واستعماله من قبل الجهات المستفيدة في القطر في مكافحة بعض الآفات التي تصيب الاشجار والمحاصيل المهمة اقتصادياً. اظهرت النتائج بأن المبيد الحيوي بنسبة (25) غم بذور رز/ لتر زيت قد اعطى نتائج عالية المعنوية من حيث تركيز ابواغ الفطر في وحدة الحجم (مل)، إذ بلغ (1.82×10 6) بوغ/ مل. واثبتت نتائج التقييم المختبري كفاءة المبيد الحيوي المنتج على وفق المعايير الاتية:
عدم حدوث تغيير في تركيز ابواغ الفطر في وحدة الحجم (مل) من المبيد الحيوي خلال المدة الخزنية المقررة والتي امدها (6) اشهر، حيث بلغ في بداية الانتاج (1.82×10 6) بوغ/ مل واستمر بالتركيز نفسه الى نهاية المدة الخزنية.
أظهر المبيد الحيوي المنتج وبجميع تراكيزه المستعملة في المختبر كفاءة عالية في مكافحة بالغات حشرة من الخوخ الاخضر Myzus persicae.
لم تتأثر حيوية الفطر عند اضافة مادة الاستحلاب Emulsifier عند فترة الخزن المذكورة .
استعملت العديد من الأحياء الدقيقة في مكافحة الكثير من الآفات الزراعية ولم يكن التركيز على الجوانب التجارية لهذه المكافحة إلا في غضون العقدين الماضيين اذ جاءت نتيجة للتطور العلمي في مجال المكافحة الإحيائية والقلق العام من مخاطر استعمال المبيدات الكيميائية الزراعية، وتمخضت الابحاث التي قام بها عدد كبير من الباحثين في مختلف دول العالم عن توظيف عدد كبير من الاحياء الدقيقة في هذا المجال (3).احتلت انواع الجنس Beauveria مركز الصدارة في هذا المجال، خاصة النوع B. bassiana الذي يسبب مرض خطير لمختلف الاطوار لعدد كبير من الحشرات الاقتصادية يعرف بـ White muscardine disease (18، 38، 17).
لوحظ هذا الفطر لأول مرة من قبل الباحث Agostino Bassi عام 1835 إذ وجده متطفلاً على دودة الحرير Silk Worm ومنذ ذلك الوقت تم استعماله لأغراض المكافحة الاحيائية (33، 19). اظهرت الدراسات اللاحقة ان الفطر لا ينتج مواد ضارة بالنبات، ولا يحدث تأثيراً بيئياً سلبياً في الوسط البيئي وليس له قدرة تطفلية على الانسان والحيوان، مما شجع العديد من الباحثين في مختلف دول العالم على دراسة امكانية استعماله في برامج المكافحة الاحيائية (13، 24، 42، 26).
تم تحميل لقاح الفطر B. bassiana صناعياً من قبل العديد من الشركات العالمية وتحت اسماء تجارية مختلفة، حيث تم استعماله على نطاق حقلي كبير في مختلف الدول المتقدمة ومنها (أمريكا، فرنسا، كندا، الصين، نيوزلندا، استراليا و البرازيل). وقد اثبت هذا المبيد فعالية كبيرة في خفض اضرار العديد من الآفات الزراعية مثل الذبابة البيضاء، المن، الخنافس، العنكبوت الأحمر، الثربس، الجراد الصحراوي، الصرصر الامريكي، الحفارات والآفات الحشرية الاخرى (27، 29، 11، 7). تهدف هذه الدراسة الى امكانية تحميل لقاح الفطر B. bassiana على اوساط مختلفة ليكون مبيد حيوي فعال واقتصادي سهل الاستعمال في مكافحة الآفات الزراعية المهمة.
عزل الفطر B. bassiana وتشخيصه :
تم عزل الفطر B. bassiana من يرقات حفار ساق النخيل ذو القرون الطويلة Jebusea hammerschmidti Reich التي تم الحصول عليها من خلال تشريح عدد من النخيل في قضاء المحاويل التابع لمحافظة بابل.حيث قطعت اليرقات الى اجزاء صغيرة بطول 3-6 ملم، ثم نقلت القطع إلى طبق زجاجي نظيف يحوي هايبوكلورات الصوديوم NaOCl بتركيز 6% لمدة دقيقة واحدة ثم ونقلت الى طبق آخر يحوي ماء معقم، ثم نقلت الى ورق ترشيح للتجفيف (30).زرعت القطع في اطباق زجاجية معقمة قطر 9 سم حاوية على اوساط زرعية اختبارية معقمة هي Beauveria medium و Veens agar medium وبمعدل ثلاثة مكررات لكل وسط وبواقع ثلاث قطع لكل طبق زجاجي. حضنت الاطباق بدرجة حرارة 25±1 مْ لمدة 72 ساعة (40، 14، 39).اعقب ذلك تسجيل الصفات المظهرية لمستعمرات الفطر المعزول وكذلك تم ملاحظة طبيعة الغزل الفطري وطبيعة الحامل الكونيدي وطريقة انتظام الابواغ على الحامل الكونيدي، فضلاً عن قياس اقطار الابواغ بأستعمال عدسة عينية مقسمة Ocular micrometer (21، 30، 42) بعدها تم تشخيص الفطر اعتماداً على الصفات التي ذكرها كل من( 8، 32، 6، 41، 20، 23).
تحضير لقاح الفطر B. bassiana:
بعد عملية عزل الفطر وتشخيصه تم تنميته اولاً على وسط PDA الصلب وبعد تحضيره وتعقيمه وصبه في اطباق معقمة، بعدها حضنت الاطباق بدرجة حرارة 25±1مْ ولمدة 7 ايام (35).اعقبها اكثار الفطر B. bassiana على الوسط الغذائي السائل (P. S.) الموضوع في دوارق زجاجية سعة (250) مل، حيث عقمت بجهاز الضغط البخاري (الموصده) بدرجة حرارة (121)مْ وضغط (15) باوند/ أنج2 ولمدة (20) دقيقة (42). اضيف اليها بعد التبريد المضاد الحيوي Penicillin بتركيز (4) غم/ لتر , Streptomycin بتركيز (1) غم/ لتر، اعقب ذلك عمل اقراص بقطر (4) ملم من حافة المستعمرات، الفطرية النامية على الوسط الغذائي الصلب (PDA) بعمر اسبوع، باستعمال آلة ثقب الفلين ثم نقلت تلك الاقراص وفي ظروف التعقيم التام الى الدوارق الحاوية على الاوساط الغذائية السائلة وبمعدل قرصين لكل دورق وبعد تحريك الدوارق قليلاً وبلطف حضنت بدرجة حرارة 25±1مْ لمدة 7 أيام (1).
تحميل لقاح الفطر B. bassiana على بذور الرز
تم اخذ 600 غم من بذور الرز ووزعت بالتساوي في ثلاثة دوارق زجاجية سعة 500مل ثم اضيف الى كل دورق 20 مل ماء مقطر، بعدها عقمت الدوارق بجهاز الضغط البخاري (الموصدة) بدرجة حرارة 121 مْ وضغط (15) باوند/ انج2 ولمدة 20 دقيقة ثم تركت لتبرد واضيف لكل دورق 40 مل من لقاح الفطر المحضر سابقا بعمر سبعة أيام حضنت الدوارق بدرجة ( 25± 1 ) مْ لمدة (21 ) يوما (42). بعدها جففت الدوارق في مجفف كهربائي بدرجة حرارة 35مْ ولمدة ثلاثة أيام، ثم طحنت وغربلت في ظروف معقمة .
مزج لقاح الفطر B. bassiana المحمل على بذور الرز مع زيت زهرة الشمس
في هذه المرحلة تم مزج الفطر المحمل على بذور الرز مع زيت زهرة الشمس بنسب مختلفة شملت 0، 5، 10، 15، 20، 25 غم بذور رز/ لتر زيت. بعدها مزج الخليط جيداً بالخلاط الكهربائي لمدة خمس دقائق، ثم تمت تعبئته بقناني زجاجية نظيفة معقمة سعة 500مل، بعدها تم حساب تركيز ابواغ الفطر في وحدة الحجم (مل) من المبيد الحيوي لكل النسب المختبرة من خلال اخذ واحد مل من المبيد الحيوي (بحسب كل نسبة) يضاف الى 9 مل ماء مقطر معقم، في انابيب اختبار سعة 20 مل، اجريت سلسلة تخافيف 10-1 – 10-5 في ظروف التعقيم التامة مع استعمال ماصة نظيفة معقمة لكل تخفيف على حدة. نقل واحد مل من التخفيف 10-4 – 10-5 الى أطباق بتري معقمة قطر 9 سم حاوية على الوسط الغذائي (PDA) المعقم والمضاف اليه المضاد الحيوي Penicillin بتركيز 4 غم/لتر و Streptomycin بتركيز 1 غم/ لتر، وبمعدل 20 مل وسط غذائي/ طبق، وبواقع ثلاثة مكررات (39، 22). حضنت الاطباق بدرجة حرارة 25±1مْ لمدة 72 ساعة. بعدها حُسب تركيز ابواغ الفطر في المل الواحد حسب معادلة (15).
اجريت تجربة مختبرية لاختبار كفاءة المبيد الحيوي المنتج بنسبة 25 غم بذور رز/ لتر زيت وذلك بالاعتماد على نتائج التجربة الواردة في الفقرة (3. 2 )ضد بالغات حشرة من الخوخ الاخضر M. persicae بعد اضافة مادة emulsifiers بتركيز بين 0,5 – 0,75 % مع الرج بدرجة حرارة 25- 30 مْ وكالاتي:-
تهيأة بالغات من الخوخ الاخضر M. persicae
تم جمع بالغات حشرة المن من نباتات فجل مصابه بها وشخصت استناداً الى 4 ووزعت على اطباق بلاستيكية قطر 9 سم نظيفة ومعقمة يحوي كل منها على ورقة ترشيح وبواقع 20 حشرة/ طبق وبمعدل ثلاثة مكررات لكل تركيز من المبيد الحيوي ومثلها لمعاملة السيطرة، وأضيف لكل طبق ورقة صغيرة من نبات الفجل كغذاء (12).
تهيأة تراكيز مختلفة من المبيد الحيوي
تم تحضير تراكيز مختلفة من المبيد الحيوي المنتج 1، 2، 3، 4, 5 مل مبيد حيوي/ لتر ماء، وذلك بأخذ حجم معين من المبيد الحيوي (بحسب التركيز المطلوب) وإذابته في لتر ماء. رشت الاطباق (عدا معاملة السيطرة ) بمعدل واحد مل محلول مبيد حيوي وحسب تركيز كل معاملة بواسطة مرشة يدوية صغيرة سعة (50) مل، بينما رشت أطباق معاملة السيطرة بمعدل واحد مل محلول المادة الحاملة (زيت + ماء)، (35). حضنت جميع المعاملات في درجة حرارة 25±1 مْ ولمدة خمسة أيام.
تم حساب النسب المئوية لهلاك البالغات يومياً ابتداء من اليوم الاول بعد المعاملة بالمبيد الحيوي وانتهاء باليوم الخامس بحساب عدد الحشرات الميتة بعد فحص كل حشرة ميتة بالمجهر، ومن ثم زراعتها على وسطي (Beauveria medium و Veens agar medium) بعد تعقيمها بمحلول هايبوكلورات الصوديوم 6%( 12، 38، 30) حضنت جميع المعاملات بدرجة حرارة 25±1 مْ ولمدة 72ساعة وفحصت جميع المستعمرات الفطرية النامية على الوسط الزرعي للتأكد من كونها تمثل الفطر B. bassiana.
بعد الانتهاء من عملية انتاج المبيد الحيوي تم تخزينه في علب زجاجية نظيفة ومعقمة سعة 500مل، وتحت ظروف المختبر. وبعد مرور ثلاثة اشهر من الانتاج تم تقدير تركيز ابواغ الفطر في وحدة الحجم (1 مل) من المبيد الحيوي وبنفس الاسلوب الوارد في الفقرة( 3. 2 ) وكررت العملية ايضاً بعد مرور ستة اشهر من انتاج المبيد الحيوي.
حللت جميع التجارب المختبرية وفق نموذج التصميم العشوائي الكامل (C.R. D.) Completely Randomized Design وتمت مقارنة المتوسطات حسب اختبار اقل فرق معنوي (L. S. D.) وعلى مستوى احتمال (0.05) (2).
عند تنمية الفطر على وسطي (Beauveria medium و Veens agar medium) ظهر بشكل مستعمرات دائرية بيضاء اللون قطنية دقيقية الشكل. المايسيليوم شفاف والحوامل الكونيدية Conidiophores غير متفرعة تحمل Phialides تنشأ منها الابواغ الكونيدية Conidiospors التي تمتاز بلونها الشفاف وشكلها الكروي الى البيضوي ذات اقطار تراوحت(2-3) × (2-2.5) مايكروميتر وكانت مرتبة على الحامل الكونيدي بشكل متناظر (Sympodulosporae) وهذه الصفات التشخيصية تتطابق مع ما توصل اليه ( 8، 16، 25، 9، 34، 10، 20، 23).
مزج لقاح الفطر B. bassiana المحمل على بذور الرز مع زيت زهرة الشمس:
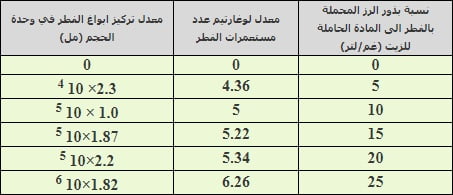
تشير النتائج الواردة في جدول (1) الى وجود تفوق معنوي لنسبة بذور الرز المحملة بلقاح الفطر الى المادة الحاملة (الزيت) 25 غم بذور رز/ لتر زيت على بقية النسب الاخرى، إذ بلغ اعلى تركيز لأبواغ الفطر في وحدة الحجم (مل) عند هذه النسبة وكان (1.82×10 6) بوغ/ مل، وبفروق عالية المعنوية عن تراكيز ابواغ الفطر في النسب الاخرى. حيث كان التركيز في النسب 0، 5، 10، 15، 20 غم بذور رز/ لتر زيت مختلف احصائياً وبلغ 0، 2.3× 10 4، 1.0 × 10 5، 1.87×10 5 و 2.2×10 5 بوغ/ مل على التوالي. توضح هذه النتائج انه كلما ازدادت نسبة بذور الرز الى المادة الحاملة كلما ازداد تركيز ابواغ الفطر في وحدة الحجم (مل)، لذا تم اعتماد نسبة (25) غم بذور رز/ لتر زيت.
جدول (1) : تأثير نسبة بذور الرز (المحملة بالفطر) الى المادلة الحاملة (الزيت) على معدل تركيز ابواغ الفطر في وحدة الحجم ( مل )
تقييم كفاءة المبيد الحيوي
أثير تراكيز مختلفة من المبيد الحيوي في معدلات نسب هلاك بالغات حشرة من الخوخ الاخضر M. persicae
اوضحت النتائج الواردة في شكل (1) ان تركيز (5) مل مبيد حيوي/ لتر ماء، قد سبب اعلى نسبة هلاك لحشرة المن، حيث بلغت (57%) وبتفوق معنوي على جميع التراكيز الاخرى. كما أظهرت التراكيز الاخرى فعالية جيدة في مكافحة الحشرة، إذ بلغت معدلات نسب الهلاك في التركيزين (3و4) مل مبيد حيوي/ لتر ماء، (41 و 47%) على التوالي، ومن ناحية اخرى سببت التراكيز (1و2) مل مبيد حيوي/ لتر ماء، نسب هلاك مرتفعة للحشرة مقارنة بمعاملة السيطرة (تركيز صفر).
من هذا يتضح ان للتراكيز دوراً مهماً في زيادة النسب المئوية للهلاك حيث وجد ان هناك علاقة طردية ما بين تركيز الابواغ ونسب الهلاك حيث كلما ازداد التركيز ارتفع معدل هلاك الحشرة، وهذا قد يعود الى زيادة الوحدات الفعالة من الفطر (الابواغ) بزيادة تركيز المبيد الحيوي المستعمل.
هذه النتائج تتفق مع كل من 38، 36، 5، 43 حيث اشاروا الى ان نسب الهلاك للحشرات تكون ضعيفة في التراكيز القليلة وتتجه للتضاعف بزيادة التراكيز البوغية المستعملة.
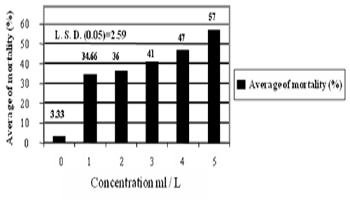
شكل (1). تأثير تراكيز مختلفة من المبيد الحيوي في معدلات نسبة هلاك بالغات حشرة من الخوخ الاخضر
تأثير الفترة الزمنية في معدلات نسب هلاك بالغات حشرة من الخوخ الاخضر
النتائج الموضحة في شكل (2) تؤشر ان للفترة الزمنية بعد المعاملة بالمبيد الحيوي اهمية كبيرة في التأثير على نسبة الهلاك. فقد بلغت تلك النسبة اقصاها بعد مرور خمسة ايام من المعاملة بالمبيد الحيوي حيث بلغت (80.66%). وفي الوقت نفسه لم يؤثر المبيد الحيوي بشكل فعال في نسب هلاك الحشرة بعد مرور يوم واحد من المعاملة، وقد يعود السبب الى عدم اخذ الفطر الوقت الكافي لاختراقه جدار جسم الحشرة بعملية التحلل الانزيمي (Chitinase و Proteinase) وبالتالي يكون سلوك الحشرة طبيعياً خلال الايام الاولى رغم معاملتها بالمبيد.
اوضحت النتائج أن لعامل الزمن اهمية في المكافحة الاحيائية حيث كلما ازدادت الفترة الزمنية بعد المعاملة بالمبيد الحيوي ازدادت معدلات هلاك الحشرة وهذه النتائج تماثل ما توصل اليه كل من 28، 31، 42، 17 الذين اشارو الى ان الفترة الزمنية لها دور مهم في المكافحة الاحيائية حيث تتناسب طردياً مع نسب الهلاك عند توفر الظروف الملائمة.
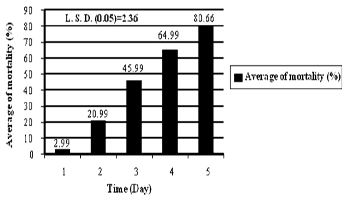
شكل (2). تأثير الفترة الزمنية في معدلات نسب هلاك بالغات حشرة من الخوخ الاخضر M. persicae
تأثير التداخل بين تراكيز المبيد الحيوي والفترة الزمنية في معدلات نسب هلاك بالغات حشرات من الخوخ الاخضر
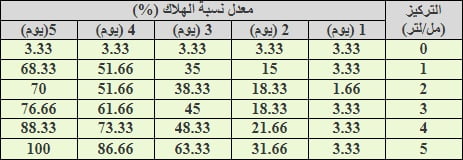
يعد التداخل بين تراكيز المبيد الحيوي والفترة الزمنية بعد المعاملة من التداخلات ذات الاثر الفعال في كفاءة المبيد الحيوي ضد الحشرة المختبرة. فتداخل تركيز المبيد الحيوي (5) مل/ لتر مع الفترة الزمنية الخامسة (خمسة ايام بعد المعاملة) سبب اعلى نسب هلاك للحشرة إذ بلغت 100% كذلك كان لتداخل التراكيز الاخرى مع الفترة الزمنية الخامسة اثر كبير ضد الحشرة إذ تراوحت نسب الهلاك بين (68.33 – 88.33%) بينما اعطى تداخل التراكيز المختلفة مع الفترة الزمنية الاولى (بعد مرور يوم واحد من المعاملة) اقل نسب هلاك للحشرة (جدول2).
وتشير النتائج الى ان زيادة التركيز المستعمل مع طول الفترة الزمنية لمعاملة الحشرة بالمبيد الحيوي تؤدي الى زيادة كفاءة المبيد الحيوي ضد الحشرة، فمن البديهي ان زيادة التركيز تؤدي الى زيادة كفاءة المبيد الحيوي وهذا ينطبق على جميع المبيدات الكيمياوية والاحيائية ولكن اهمية الفترة الزمنية بعد المعاملة تتجلى في المبيدات الاحيائية أكثر من المبيدات الكيمياوية لكون الكائن المجهري يحتاج الى فترة زمنية اطول ليصبح مؤثراً في الآفة (3، 29، 37)
جدول (2): تأثير التداخل بين تراكيز المبيد الحيوي والفترة الزمنية في معدلات نسب الهلاك لحشرة المن
تحديد قابلية المبيد الحيوي للخزن
أظهرت النتائج المبينة في جدول (3) عدم وجود اختلاف معنوي في تركيز ابواغ الفطر في وحدة الحجم (مل) من المبيد الحيوي المنتج بعد مرور ثلاثة وستة اشهر من عملية انتاج المبيد الحيوي عندما خزن في درجة حرارة المختبر 25±2مo.
جدول (3): الكفاءة الخزنية للمبيد الحيوي بعد مرور (3 و6) اشهر من الانتاج

Abstract:
This study included the possibility of producing bio-pesticidal from inoculum of fungus Beauveria bassiana (Balsamo) Vuillemin isolated from longhorn date palm stem borer larvae to be loaded onto easy carrying substances, and its production economically, and on wide-scale commercial basis, so that it can be circulated and used by beneficiaries in the country for controlling pests that infect trees and important economic crops.
The results showed that the bio-pesticide of a percentage of (25) gm rice seeds/ litter (oil) has given great significant results as far as spore percentage in unit volume (ml) is (1.8 ×106). The results of the laboratory evaluation proved the efficiency of the produced bio-pesticide according to the following standards:
There was no change in the concentration of the fungal spores per unit volume (ml) of bio-pesticide during the pre-assigned storage period that lasted six months. On the start of production it reached (1.82×106) spore/ ml, and remained the same to the end of the storage period.
The produced bio-pesticide of all concentrations used in the laboratory high efficiency in the control of green-peach insect adults Myzus persicae.
The fungus viability was not affected by the addition of an emulsifier during the fore-mentioned storage period.
الحيدري، نظام كاظم عبد الامير ورشيد محجوب المصلح. 1989. الاحياء المجهرية الصناعية. مطابع التعليم العالي في الموصل. (688) صفحة.
الراوي، خاشع محمود وعبد العزيز خلف الله. 1980. تصميم وتحليل التجارب الزراعية. دار الكتب للطباعة والنشر – جامعة الموصل . (488) صفحة.
الزبيدي، حمزة كاظم. 1992. المقاومة الحيوية للآفات. دار الكتب للطباعة والنشر. جامعة الموصل. (440) صفحة.
العزاوي عبد الله فليح. 1980. علم الحشرات العام والتطبيقي. مطبعة الزهراء- بغداد. (540) صفحة.
Barnett, H. T.and Hunter, B. B. 1972. Illustrated genera of imperfect fungi. Printed in United State of American. Burgess Publishing company. Minnesote. 241PP.
Barr, C. L.; Lennon, L. and Russel, S. 2000. Final report on testing TB, 1-31, a Beauveria bassiana product manufactured by troy biosciences for the control individual colonies of red important fire ants. Mycol. Res. Taxas. 1-11.
Banham, R. W. and Miranda J. L. 1935. The genus Beauveria morphological and taxonomical studies of several species and two strain isolated from whar F-piling borers. Mycologia. 45: 727-764.
Bissett, J. and widden, P. 1988. A new species of Beauveria isolated from Scottish moorland soil. Canadian. J. Bot. 66. 361-362.
Bradley, C. A.; Black, W. E.; Kearns, R. and wood. P. 1992. Role of production technology in mycoinsesctiside development. In: Leatham, G. F. (Ed.), Frontiers in industrial mycology. Chapman and hall, New York. 160-173.
Burges, H. D. 1998. For mutation of microbial bio-pesticides: beneficial microorganisms, Nematodes and seed treatments. Kluwer Academic drodecht ISBN.7-27.
Butt, T. M.; Ibrahim, L.; Ball, B. V. and Clark, S. J. 1994. Pathogenecity of the entomogenous fungi Beauveria bassiana and Metrhizium anisopiliae against crucifer pest and honey bee. Bio-control science and technology. 4:207-214.
Carruthers R. I. and Poprawski, T. J. 1994. Use of exotic fungal isolated against indigenous pest insects. Pro. VIth Int. Collq. Inverteber. Pathol. France. 1:334-342.
Chase, A. R.; Osborne, L. S. and Ferguson, V. M. 1986. Selective isolation of the entomopathogenic fungi Beauveria bassiana and Metrhizium anisopiliae from an artificial potting medium. Fla. Entomol. 69:285-292.
Clark, F. E. 1965. Agar-plates method for total microbial (c. f.: Black, 1965 methods of soil analysis part2 publisher Madison, Wisconsin, USA pp.1572).
Dehoog, G. S. 1972. The genera Beauveria, Isoria, Tritirachium and Acrodontium gen nov. Studies in Mycology 1:1-41.
Ellie, G.and Maine, O. Z. Using Beauveria bassiana for insect management. United States Department of Agricultural Research service .94-97.
Feng, M.G.; Poprowski, J. and Khatchatourians ,G.G.1994. Production formulation and application of the entomopathogenic fungus Beauveria bassiana for insect control: current status .Biocont .Sci.Tech.4:3-34.
Glare, T. R. and Milner, R. J. 1991. Ecology of entomopathogenic Fungi. In: D.K Arora; L. Agello; KG. Mukerji (eds), Handbook of Applied Mycology, vol. 2, human, animal and insects, Marcel Dekker. Inc. New York. 547-612.
Glare, T. R. 1992. Fungal Pathogens of scarabs. In: use of pathogens in scarabs pest management (T. A. Jakson and Glare. eds), Intercept. Andover. 63-77.
Glare, T. R.; Ocallaghen, M. and Wigley, P. J. 1993. Checklist of naturally occurring entomopathogenic microbes and nematodes in New Zealand. N. Z. J. Zool. 20: 95-120.
Glare, T.R. and Nelson, T. L. 1996. Large scale production of New Zealand strains of Beauveria and Metrhizium. N. Z. plant prod. Soci. 10-16.
Glare, T. R. and Inwood, A. 1998. Morphological and genetic characterization of Beauveria Spp. From New Zealand. Mycol. Res. 102:250-256.
Goettel, M. S. 1995. The utility bioassays in the risk assessment of entomopathogenic fungi. University of Maryland. Fla. (301): 403-469.
Hall, R. A.; Zimmermann, G. and Vey, A. 1982. Guidelines for the registration of entomogenous fungi as insecticides. Entomophaga. 27: 121 – 127.
Hazed, S. B. 1999. Federal register document related material EPA. 64(81): 22793-22796.
Inglis, G. D.; Johnson, D. and Goettel, M. S. 1996. Note on oil-bait bioassay method used to test the efficacy of Beauveria bassiana against grass hopper. J. Invertebr. Pathol. 67: 215-312.
Inglis, G. D.; Johnson, D. L.; Cheng, K. J. and Goettel, M. S. 1997. Use of pathogen combination to overcome the constrains of temperature on entomopathogenic hyphomycetes against grass hoppers. Biological control. Academic press. 8(2): 143-152.
Jaronski, S. T. and Goettel, M. S. 1997. Development of Beauveria bassiana for control grass hopper and locusts. Memories of Entomological, Society of Canada. 171:225-237.
Lacey, L. A. 1997. Manual of Technique in insect pathology. Academic Press. Santiago. CA. 409 pp.
Lyz, C.; Tigano, M. S.; Silva, I. G.; Corderio, C. M. T. and Aljanabi, S. M. 1998. Selective of Beauveria bassiana and Metrhizium anisopiliae isolates to control Triatoma infesonns. 93(6): 839-846.
Macleod, D. M. 1954. Investigations in the genera Beauveria Vuillemin and Tritirachium Limber. Can. J. Bot. 32: 818-890.
Micheal, J. P. and Rodend, R. 1972. Microbiology. Third edition. Printed in United States of American. 665-666.
Mugani, L.; Bridge, P. D. and Evans, H. C. 1989. A chemotaxonomic evaluation of the genus Beauveria. Mycol. Res. 92: 199-209.
Navon, A. and Ascher, K. R. 2000. Bioassay of entomopathogenic microbes and nematodes. CABI publishing is a division of CAB International. UK. 324 PP.
Olson, D. L. and Oehing, R. D. 1999. The efficacy of mycoinsecticides of Beauveria bassiana, against silver leaf white fly on poinsettia. Agr. Urban Entomol. 16(3): 179-185.
Reinert, J. A.; Knauf, T. A.; Maranz, S. J. and Bishr, M. 1999. Effect of Beauveria bassiana fungus on the box elder and red shouldered buds. Fla. Entomol. 82(3): 469-474.
Streett, D. A. and Woods, S. A. 1996. User Handbook: Their Biology, identification and management. Section VI. (16): 260 pp.
Townesend, R. J.; Glare T. R. and Willoughby, B. E. 1995. The Fungi Beauveria spp. Cause grass grub population collapse in some Waikato pastures. Proc. 48th. N. Z. palnt Prot. Conf. 237-241.
Veen, K. H. and Ferron, P. 1966. A selective medium for isolation of Beauveria bassiana and Metrhizium anisopiliae. J. Invertebr. Pathol. 8: 268-269.
Von arx, J. A. 1988. Notes on Beauveria Persoonia. 13: 467-469.
Willoughby, B. E.; Glare, T. R.; Kettlewell. F. J. and Nelson T. L. 1998. Beauveria bassiana as a potential bio-control agent against the clover root weevil, Sitona lepidus. Proc. 5 Ist N. Z. Plant Prot. Conf. 9-15.
Wraight, S. P.; Carruthers, R. I.; Jaronski, S. T.; Barodley, C. A. and Graza, C. J. 2000. Evaluation of the entomopathogenic fungi Beauveria bassiana and Paecilomyces fumosoroseus for microbial control of the silver leaf white fly, Bemisia argentifolii. Bio-control. 17(3): 203-217.
منشور في : مجلة البصرة لابحاث نخلة التمر مجلد 2 العدد 1،2 سنة 2002





